|
§ 6. Парообразование
и конденсация.
1. Испарение.
Существует три агрегатных состояния вещества: твердое, жидкое и газообразное.
Переход вещества из жидкого
состояния в газообразное называется парообразованием, а обратный переход –
конденсацией.
Виды парообразования: испарение
и кипение.
Испарение обусловлено хаотическим
движением молекул и и происходит только со свободной поверхности, граничичащей
с газообразной средой. Вылетая из жидкости, молекулы должны преодолеть силы
притяжения, действующие со стороны других молекул, т.е. совершить работу выхода.
Сделать это могут только быстрые молекулы. Таким образом, в жидкости остаются
молекулы с малой кинетической энергией, поэтому жидкость при испарении охлаждается.
Испарение и конденсация всегда
происходят одновременно, но один из этих процессов может преобладать. Скорость
испарения зависит от:
– природы жидкости;
– температуры;
– площади свободной
поверхности;
– плотности
паров жидкости над поверхностью;
– внешнего
давления.
Поскольку среднее расстояние
между молекулами в жидком состоянии меньше, чем в газообразном, объем вещества
при парообразовании увеличивается.
Парообразование сопровождается
поглощением теплоты из окружающей среды. Теплота парообразования прямо пропорциональна
массе вещества:
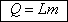
Удельная теплота парообразования
измеряется количеством теплоты, необходимым для превращения в пар единицы массы
жидкости.
[L] = Дж/кг.
С ростом температуры удельная
теплота парообразования уменьшается.
2. Насыщенный
пар. Если плотность пара над поверхностью жидкости велика, то конденсация
может происходить с той же скоростью, что и испарение, т.е. число молекул, покидающих
жидкость в единицу времени, равно числу молекул, возвращающихся в нее. В таком
случае говорят, что пар находится в состоянии подвижного равновесия со своей
жидкостью.
Пар, находящийся в подвижном
равновесии со свей жидкостью, называется насыщенным.
Покажем, что насыщенный пар
газовым законам не подчиняется. Пусть в цилиндре с поршнем находится ненасыщенный
пар (рис. 6.1.A). При изотермическом сжатии давление и плотность увеличиваются
до тех пор пока пар не приходит в состояние насыщения (рис. 6.1.B). При дальнейшем
сжатии в цилиндре появляется жидкость, а давление пара остается постоянным (рис.
6.1.C). После того как весь пар превращается в жидкость, дальнейшее сжатие ведет
к резкому скачку давления (рис. 6.1.D).
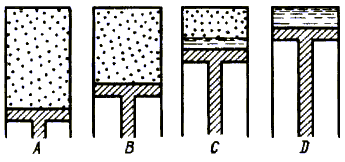
Рис. 6.1.
На
рис. 6.2 показана зависимость давления от объема в данном опыте, и отмечены
точки A, B, C и D, отражающие состояния пара, изображенные на рис. 6.1. Пока
в цилиндре ненасыщенный пар, сжатие происходит по изотерме в соответствии законом
Бойля–Мариотта (участок AB). При дальнейшем сжатии объем жидкости увеличивается,
а давление остается постоянным (участок BD). Таким образом, давление насыщенного
пара не зависит от объема.
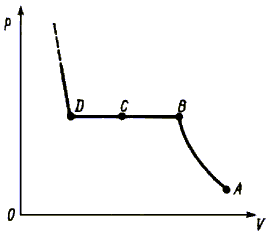
Рис. 6.2.
Давление
и плотность насыщенного пара увеличиваются с ростом температуры. Плотность насыщенного
пара показывает какое максимальное количество пара может содержаться в единице
объема при данной температуре.
Закон
Дальтона:
Давление смеси
паров и газов равно сумме давлений, создаваемых каждым из них в отдельности,
если между ними нет химического взаимодействия.
Следствием закона
Дальтона является утверждение: присутствие над поверхностью насыщенного пара
одной жидкости не мешает испаряться другой.
3. Влажность
воздуха.
Количество водяного пара,
содержащегося в 1 м3 воздуха, называется абсолютной влажностью.
[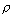 а
] = г/м3. а
] = г/м3.
Относительная влажность воздуха
это число, показывающее сколько процентов от плотности насыщенного пара при
данной температуре составляет абсолютная влажность.
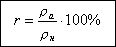
Температура, при которой
воздух в процессе своего охлаждения становится насыщенным водяными парами, называется
точкой росы.
[tр ] = °C
4. Критическое
состояние вещества. С повышением температуры плотность насыщенного пара
увеличивается, а плотность жидкости в результате теплового расширения уменьшается
(рис. 6.3).
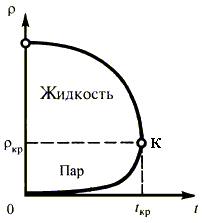
Рис. 6.3.
Температура,
при которой плотность жидкости и плотность ее насыщенного пара становятся одинаковыми,
называется критической.
При критической температуре
различия между жидкостью и паром стираются. Вещество при этом находится в критическом
состоянии, и параметры этого состояния называются критическими. Для воды, например,
tкр = 374 °C, pкр = 219 атм,  кр
= 329 кг/м3. кр
= 329 кг/м3.
5. Реальный
газ.
График изотермического
процесса для идеального газа в координатах p,V представляет гиперболу.
Для реального же газа экспериментальная изотерма имеет горизонтальный участок
(рис. 6.4).
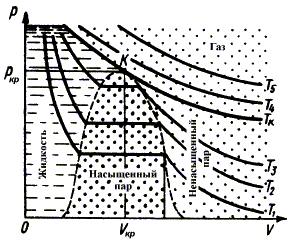
Рис. 6.4.
Если
состояние идеального газа описывается уравнением Клапейрона-Менделеева:
pV = 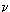 RT, RT,
то для описания состояния реального газа следует использовать
экспериментально полученное уравнение Ван-дер-Ваальса:
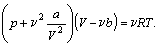
Параметры a и b в этом уравнении индивидуальны
для каждого газа. Для воды, например, они равны:
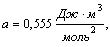
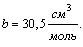
Параметры a
и b могут быть выражены через критические
параметры газа:
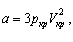
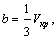
здесь Vкр – объем 1 моля газа в критическом
состоянии.
6. Кипение.
Парообразование, происходящее
в объеме всей жидкости при постоянной температуре, называется кипением.
Условие кипения:
Жидкость закипает при такой
температуре, при которой давление ее насыщенного пара сравнивается с внешним
давлением.
Таким образом, температура кипения
жидкости не является фиксированной величиной. При понижении внешнего давления
температура кипения уменьшается, а при повышении – увеличивается.
Вода, например, закипает при
100 °C только, если давление равно 1-й атмосфере. При давлении 0,5 атмосфер
вода закипит при 80 °C, а при давлении 2 атмосферы – при 120 °C.
|



