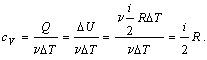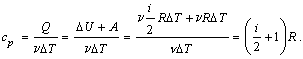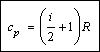|
§ 4. Термодинамика
газа.
1. Теплообмен.
Под
внутренней энергией подразумевается сумма кинетической энергии всех частиц тела
и потенциальной энергии их взаимодействия.
[U] = Дж.
В соответствии с определением можно записать:
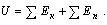
Следует понимать, что во внутреннюю энергию не включаются кинетическая
и потенциальная энергия самого тела.
Обмен внутренней
энергией между телами называется теплообменом.
Виды теплообмена:
теплопроводность, излучение, конвекция. Мерой изменения внутренней энергии служит
количество теплоты:
[Q] = Дж.
Количество теплоты,
расходуемое на нагревание тела, прямо пропорционально его массе и изменению
температуры:
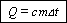
Удельная теплоемкость
вещества измеряется количеством теплоты, необходимым для нагревания единицы
массы вещества на 1°C.
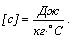
Большой удельной
теплоемкостью обладает, например, вода:
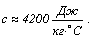
У металлов удельная теплоемкость в 5–10 раз меньше этого значения.
Следует отметить, что тепловые свойства вещества зависят от агрегатного состояния,
поэтому удельная теплоемкость льда другая:
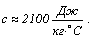
Поскольку вода играет огромную роль в жизни человека, по ее удельной
теплоемкости была введена специальная единица измерения количества теплоты.
Калория это
количество теплоты, необходимое для нагревания 1 г грамма воды на 1°C.
1 кал 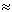 4,2 Дж.
4,2 Дж.
Данное соотношение полезно запомнить.
Внутренняя энергия
может частично высвобождаться при реакции горения. Количество теплоты, выделяемое
при сжигании топлива, прямо пропорционально его массе:
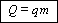
Удельная теплота
сгорания (калорийность) измеряется количеством теплоты, выделяющемся при полном
сгорании единицы массы топлива.
[q] = Дж/кг.
Расход газообразного
топлива удобнее измерять объемом при нормальных условиях, поэтому для газа имеем:
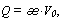
где [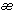 ]
= Дж/м3 – калорийность
газообразного топлива. ]
= Дж/м3 – калорийность
газообразного топлива.
За единицу условного
топлива принята удельная теплота сгорания каменного угля:
q = 29,3 МДж/кг.
Например, нефть
имеет калорийность 1,5 условных единиц. Это означает, что калорийность нефти
в 1,5 раза больше, чем каменного угля.
При сжигании
топлива не всю выделяющуюся теплоту удается использовать. Эффективность нагревателя
характеризуется коэффициентом полезного действия (к.п.д.).
К.п.д. нагревателя
показывает, какую часть от выделившейся при сжигании топлива теплоты составляет
полезно использованная.
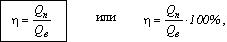
здесь Qв – выделившееся
количество теплоты,
Qп – полезно
использованное количество теплоты.
При решении задач
на теплообмен следует использовать уравнение теплового баланса, смысл
которого сводится к тому, что количество теплоты, отданное нагретыми телами,
равно количеству теплоты, полученному "холодными" телами:
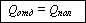
2. Работа
газа при изобарическом процессе. Газ в отличие от жидкостей и твердых тел
при нагревании не только увеличивает внутреннюю энергию, но и совершает работу,
которая зависит от процесса, совершаемого над ним.
Газ совершает работу только
при расширении.
Пусть в цилиндре с подвижным
поршнем находится газ (рис. 4.1). При нагревании газ расширяется, и поршень
перемещается на расстояние  h.
При этом давление равно атмосферному, т.е. остается постоянным. h.
При этом давление равно атмосферному, т.е. остается постоянным.
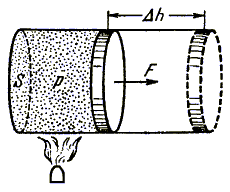
Рис. 4.1.
Работа
газа равна произведению силы, действующей на поршень, на перемещение:
A = F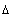 h. h.
Поскольку давление равно отношению силы к площади поверхности, то сила может
быть выражена через давление:
F = p·S.
Тогда:
A = p·S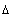 h. h.
Из рисунка видно, что выражение S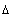 h
равно объему части цилиндра, ограниченной начальным и конечным положением поршня.
Этот объем равен изменению объема газа, следовательно: h
равно объему части цилиндра, ограниченной начальным и конечным положением поршня.
Этот объем равен изменению объема газа, следовательно:
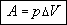
3. Геометрический
смысл работы газа. Изобразим на графике в координатах p,V
процесс, в котором газ изобарически переходит из 1-го состояния во 2-е (рис.
4.2). Стороны заштрихованного под графиком прямоугольника равны p и 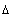 V,
поэтому работа газа при изобарическом процессе равна площади этого прямоугольника. V,
поэтому работа газа при изобарическом процессе равна площади этого прямоугольника.
Рис. 4.2. |
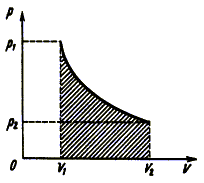
Рис. 4.3. |
Обобщая
полученный результат на любой процесс, например, изотермический (рис. 4.3),
можно сделать вывод:
Работа газа при произвольном
процессе равна площади криволинейной трапеции под графиком изображающим этот
процесс в координатах p,V.
4. Физический
смысл молярной газовой постоянной. Пусть идеальный газ изобарически переходит
из 1-го состояния во 2-е. Давление в обоих состояниях одинаково, обозначим его
p. Для любого состояния справедливо уравнение Клапейрона-Менделеева,
поэтому можем записать:
p1V1
= 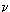 RT1 и p2V2
= RT1 и p2V2
= 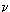 RT2. RT2.
Найдем работу газа:
A = p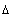 V
= p(V2 – V1) = pV2 – pV1. V
= p(V2 – V1) = pV2 – pV1.
Подставим соотношения, полученные выше, тогда:
A = 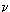 RT2
– RT2
– 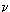 RT1 = RT1 = 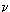 R(T2
– T1). R(T2
– T1).
В скобках стоит изменение температуры, поэтому окончательно получаем:
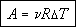
Если имеется один моль газа,
а изменение температуры составляет 1 К, то работа равна молярной газовой постоянной.
Молярная газовая постоянная
численно равна работе, совершаемой одним молем идеального газа при его изобарическом
нагревании на 1 К.
5. Внутренняя
энергия газа. В газах взаимодействием молекул друг с другом можно пренебречь,
поэтому внутренняя энергия газа определяется только суммой кинетической энергии
всех его молекул.
Если известна средняя кинетическая
энергия молекул 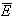 , то внутренняя
энергия газа, содержащего N молекул равна: , то внутренняя
энергия газа, содержащего N молекул равна:
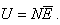
Среднюю кинетическую энергию молекул можно найти, используя формулу, предложенную
Больцманом:
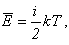
а число молекул выразить через количество вещества:
N = 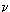 NА. NА.
Тогда имеем:
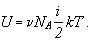
Учитывая, что произведение числа Авогадро на постоянную Больцмана равно молярной
газовой постоянной, получаем в окончательном виде формулу для определения внутренней
энергии газа:
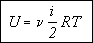
6. Первое
начало термодинамики. Сформулируем закон сохранения и превращения энергии
применительно к тепловым процессам.
Подведенная к термодинамической
системе теплота расходуется на изменение внутренней энергии и совершение работы.
Это утверждение называется первым началом термодинамики. Его можно записать
в виде формулы:
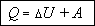
В зависимости от того какой именно процесс совершается над газом, одно из слагаемых
в этом выражении может обращаться в нуль.
1) Изобарический процесс
(p = const).
И внутренняя энергия изменяется,
и работа совершается, поэтому:
Q = 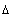 U
+ A. U
+ A.
2) Изохорический процесс
(V = const).
Поскольку расширение газа отсутствует,
то работа равна нулю, поэтому:
Q = 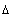 U. U.
Таким образом, газ в данном случае ведет себя при нагревании как твердое тело
или жидкость.
3) Изотермический процесс
(T = const).
Поскольку температура неизменна,
то нет и изменения внутренней энергии, поэтому:
Q = A.
В данном случае вся подведенная теплота расходуется на совершение работы.
7. Адиабатный
процесс.
Процесс, происходящий без
обмена теплом с окружающей средой, называется адиабатным.
В чистом виде адиабатные процессы
встречаются редко, однако, множество быстрых процессов, при которых теплобмен
с окружающей средой просто не успевает произойти, близки к адиабатным.
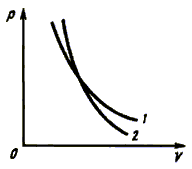
Сравним свойства изотермического
процесса и адиабатного.
В
уравнении Пуассона присутствует 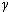 – показатель политропы, который следует брать равным 5/3, 7/5 и 4/3 соответственно
для одноатомных, двухатомных и многоатомных газов.
– показатель политропы, который следует брать равным 5/3, 7/5 и 4/3 соответственно
для одноатомных, двухатомных и многоатомных газов.
При адиабатном процессе работа
совершается только за счет изменения внутренней энергии.
8. Теплоемкость
газа.
Количество теплоты,
расходуемое на нагревание газа, прямо пропорционально количеству вещества и
изменению температуры:
Q = c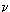 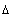 T. T.
Молярная теплоемкость
газа измеряется количеством теплоты, необходимым для нагревания 1 моля газа
на 1 K.
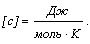
Молярная теплоемкость
газа зависит от
совершаемого над ним процесса.
1) Изохорический
процесс (V = const).
Первое начало
термодинамики для этого процесса имеет вид:
Q = 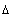 U. U.
Используя формулу, полученную выше, выражаем изменение внутренней
энергии газа:
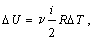
вычисляем теплоемкость:
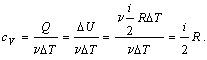
Таким образом, молярная теплоемкость при постоянном объеме равна:
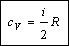
2) Изобарический
процесс (p = const).
Первое
начало термодинамики для этого процесса имеет вид:
Q = 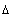 U
+ U
+ 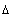 T. T.
Используя формулы, полученные выше, выражаем изменение внутренней
энергии газа:
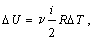
работу газа:
A = 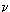 R R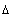 T, T,
вычисляем теплоемкость:
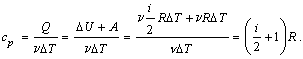
Таким образом, молярная теплоемкость при постоянном давлении
равна:
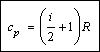
Учитывая выражение
для молярной теплоемкости при постоянном объеме, можно также записать:
cp
= сV + R.
3) Изотермический
процесс (T = const).
Поскольку температура
неизменна, то 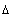 T = 0,
а теплоемкость газа равна бесконечности. T = 0,
а теплоемкость газа равна бесконечности.
4) Адиабатный
процесс (Q = 0).
Теплоемкость
газа равна нулю.
Показатель политропы
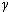 , входящий в уравнение Пуассона,
выражается через молярные теплоемкости газа при постоянном давлении и постоянном
объеме: , входящий в уравнение Пуассона,
выражается через молярные теплоемкости газа при постоянном давлении и постоянном
объеме:
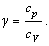
9. Второе
начало термодинамики. Тепловые процессы протекают в определенном направлении,
т.е. являются необратимыми.
Невозможен процесс, при котором
теплота самопроизвольно передается от "холодного" тела к нагретому.
Это утверждение называется вторым началом термодинамики, оно определяет
направленность процессов, их необратимость.
|