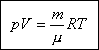|
§ 3. Газовые
законы.
1. Объединенный
газовый закон. Средняя кинетическая энергия молекул идеального газа с помощью
формулы Больцмана может быть выражена через температуру:
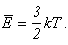
Подставляя это выражение в основное уравнение молекулярно-кинетической теории:
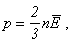
получаем:
p = nkT
Поскольку концентрация равна отношению количества молекул газа к объему:
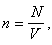
последнее выражение можем записать в виде:
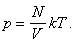
Наконец, собирая термодинамические параметры (p, V и T)
в правой части, получаем уравнение Клапейрона:
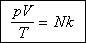
Анализируя данное выражение
можно заметить, что если масса газа фиксирована, т.е. число молекул не изменяется,
то правая часть его правая часть является константой.
Для фиксированной массы газа
произведение давления на объем, деленное на температуру, есть величина постоянная.
Объединенный газовый закон
может быть записан в форме, удобной для решения задач:
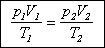
2. Молярная
газовая постоянная. Для одного моля любого газа при нормальных условиях
имеем:
p = 1 атм = 1,013·105
Па,
V = 22,4 л = 0,0224 м3,
t = 0°C или T
= 273 К.
Вычислим произведение давления на объем, деленное на температуру:
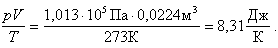
Полученное значение, отнесенное
к одному молю, называется молярной газовой постоянной:
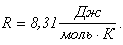
Установим ее связь с другими константами.
Запишем уравнение Клапейрона:
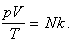
Для одного моля вещества количество молекул равно числу Авогадро, а объем, занимаемый
газом при нормальных условиях, равен молярному объему, тогда можно записать:
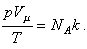
Но в левой части стоит величина, равная молярной газовой постоянной, поэтому:
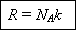
3. Изопроцессы.
Состояние данной массы газа однозначно определяется тремя параметрами: давлением
p, объемом V и температурой T. Переход газа из одного состояния
в другое называют процессом.
Процессы, при которых масса
газа и один из его параметров остаются постоянными, называются изопроцессами.
1) Изобарический процесс (p
= const).
График процесса изображен на
рис. 3.1. Поскольку давление прямо пропорционально температуре, то линии, изображающие
процесс, являются прямыми и называются изобарами. В зависимости от того, какое
именно значение давления поддерживается постоянным, они отличаются наклоном.
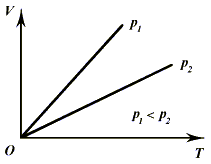
Рис. 3.1.
Запишем
объединенный газовый закон, учитывая то, что давление в обоих состояниях одно
и то же:
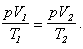
После сокращения одинакового множителя в левой и правой части, получаем установленный
французским физиком Ж. Гей-Люссаком в 1802 г. закон:
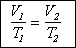
2) Изохорический процесс (V
= const).
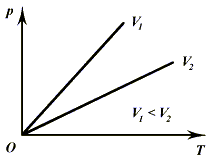
Рис. 3.2.
Как
и в предыдущем случае, процесс изображается на графике прямыми линиями (рис.
3.2), называемыми изохорами. Опираясь на объединенный газовый закон, получаем
закон, установленный в 1787 г. французским физиком Ж. Шарлем:
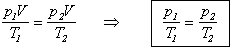
3) Изотермический процесс
(T = const).
Поскольку при изотермическом расширении газа давление обратно пропорционально
температуре, то графиком процесса служат гиперболы (рис. 3.3), которые называют
изотермами. В зависимости от того, какое именно значение температуры поддерживается
постоянным, они расположены ближе или дальше по отношению к осям.
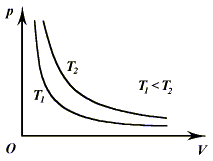
Рис. 3.3.
В
XVII в. английский физик Р. Бойль и независимо от него француз Э. Мариотт открыли
закон изменения состояния газа при изотермическом процессе:
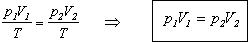
4. Уравнение
состояния газа. Состояние данной массы газа однозначно определяется значениями
давления, объема и температуры. Эти термодинамические параметры связывает, например,
уравнение Клапейрона:
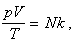
но в нем присутствует количество молекул, которое обычно не известно. Эту трудность
устранил в 1874 г. русский ученый Д.И. Менделеев.
Число молекул газа может быть
выражено через количество вещества:
N = 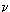 NА. NА.
Подставим это выражение в уравнение Клапейрона:
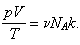
Но произведение числа Авогадро на постоянную Больцмана есть молярная газовая
постоянная, поэтому:
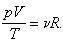
Перенесем температуру в правую часть, тогда:
pV = 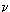 RT. RT.
Полученное соотношение называется уравнением состояния газа или уравнением
Клапейрона-Менделеева. Однако, обычно его записывают иначе, выражая количество
вещества через массу и молярную массу:
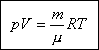
|