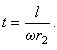|
§ 1. Основные положения
и экспериментальные обоснования молекулярно-кинетической теории.
1. Основные
положения молекулярно-кинетической теории. Идеи о строении материи из
мельчайших частиц, сохраняющих ее свойства, имеют древнегреческое происхождение.
Живший в V в. до н.э. мыслитель Демокрит утверждал: «Ничего не существует,
кроме атомов и пустого пространства; все прочее - мнение» и «различие всех
предметов состоит в различии их атомов в числе, величине, форме и порядке...».
Слово “атом” в переводе означает “неделимый”.
В основе молекулярно-кинетической
теории лежат три постулата (положения), принимаемые как результат наблюдений
и опытов:
1. Все виды вещества
состоят из молекул, между которыми имеются промежутки;
2. Молекулы в
любом веществе непрерывно и хаотически движутся;
3. На небольших
расстояниях между молекулами действуют как силы притяжения, так и силы отталкивания,
имеющие электромагнитную природу.
Эти утверждения подтверждаются
такими явлениями как, например:
– сжимаемость тел;
– диффузия;
– Броуновское движение;
– теплопроводность;
– сопротивление
сжатию и растяжению.
2.
Размеры и масса молекул. Если на спокойную поверхность воды поместить каплю
нерастворимой в воде жидкости, то образуется пленка, толщина которой равна диаметру
одной молекулы. Размеры молекул удобно выражать в ангстремах:
1 А° = 10
-10 м.
Например, молекула кислорода O2 имеет диаметр 1,2 А°, а молекула
воды H2O - 2,6 А°.
Поскольку масса молекул тоже
мала (например, у кислорода O2 она равна 5,35·10-26
кг, а у водорода H2 - 3,34·10-27 кг), то ее удобно
выражать в относительных единицах.
Атомной единицей массы называется
1/12 массы изотопа углерода C12.
1 а.е.м. = 1,66·10
-27 кг.
Относительные массы атомов указаны
в таблице Менделеева. Полезно запомнить округленные относительные массы некоторых
элементов:
| |
|
Наименование
|
Обозначение
|
Относительная
масса, а.е.м.
|
Водород
Гелий
Углерод
Азот
Кислород
Алюминий
|
H
He
C
N
O
Al
|
1
4
12
14
16
27
|
|
Относительную
молекулярную массу вещества принято обозначать Mr. Для ее вычисления
требуется установить, сколько атомов тех или иных элементов содержит молекула.
Пример
1. Молекула серной кислоты H2SO4 содержит два атома
водорода, один атом серы (32 а.е.м.) и четыре атома кислорода, поэтому:
Mr = (1·2+32+16·4)
а.е.м. = 98 а.е.м.
Иногда
бывает важно учитывать число молекул, содержащихся в данном теле, т.е. количество
вещества:
[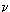 ]
= моль. ]
= моль.
Молем называется количество
вещества, масса которого в граммах равна его относительной молекулярной массе.
Масса одного моля данного вещества
называется молярной:
[µ] = г/моль.
Молярная масса вычисляется аналогично
относительной молекулярной массе, но имеет другую размерность.
Пример
2. Молекула углекислого газа CO2 содержит один атом углерода
и два атома кислорода, поэтому:
µ
= (12+16·2) г/моль = 44 г/моль.
Пример
3. Воздух является смесью газов, процентное содержание которых необходимо
учитывать при вычислении его молярной массы:
| |
|
Наименование
|
Обозначение
|
Процентное
содержание
|
Молярная
масса, г/моль
|
Азот
Кислород
|
N2
O2
|
78
%
21 %
|
28
32
|
|
Поскольку
другие компоненты (аргон, углекислый газ, гелий, водород, водяной пар и др.)
составляют всего 1%, то их содержанием можно пренебречь. Тогда получаем:
µвозд
= (28·0,78 + 32·0,21) г/моль 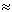 29
г/моль. 29
г/моль.
Полученное
значение следует запомнить и использовать при решении задач.
Если
известна масса вещества, то количество вещества может быть найдено по формуле:
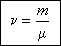
Число молекул, содержащихся
в одном моле любого вещества, есть величина постоянная и равно числу Авогадро:
NА = 6·10
23 моль-1.
Количество молекул, содержащихся
в веществе, может быть найдено по формуле:
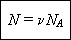
При нормальных условиях один
моль любого газа занимает объем:
Vµ = 22,4
л/моль.
В дальнейшем под нормальными
условиями будем понимать такое состояние газа, при котором:
p = 1 атм,
t = 0°C.
3. Опыт
Штерна. В 1920 г. немецким физиком О. Штерном была проведена экспериментальная
проверка закона распределения молекул по скоростям. Созданная им установка (рис.
1.1) состояла из двух полых цилиндров A и B, расположенных соосно.
По оси O цилиндров располагалась посеребренная платиновая проволока.
При пропускании электрического тока проволока нагревалась, и атомы серебра отрывались
от ее поверхности. Большинство из них оседали на внутренней стенке цилиндра
A, а часть атомов, пролетев через узкую щель, образовала на внутренней
стенке цилиндра B узкую полоску серебра.
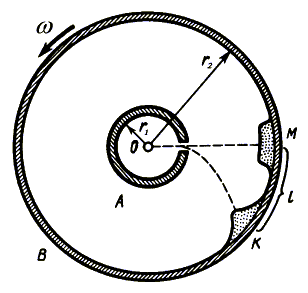
Рис. 1.1.
При
неподвижных цилиндрах атомы серебра откладывались напротив щели в точке M,
а толщина слоя полоски была равномерной. При вращении цилиндров с угловой скоростью
 место отложения
атомов серебра смещалось в точку K. Объясняется это тем, что пока атом
серебра пролетает расстояние между цилиндрами, цилиндр B успевает повернуться
на некоторый угол. место отложения
атомов серебра смещалось в точку K. Объясняется это тем, что пока атом
серебра пролетает расстояние между цилиндрами, цилиндр B успевает повернуться
на некоторый угол.
Пусть  - скорость атомов серебра, тогда время их движения между цилиндрами:
- скорость атомов серебра, тогда время их движения между цилиндрами:
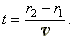
С другой стороны, за это же самое время происходит поворот цилиндра B
на дугу l, и это время равно:
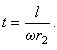
Приравниваем правые части этих выражений и из полученного уравнения находим
формулу для вычисления скорости атомов серебра:
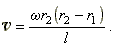
Опыт Штерна показал, что атомы
серебра движутся с разными скоростями. Об этом свидетельствует неравномерная
толщина слоя серебра в точке K. Быстрые молекулы откладывались ближе
к точке M, медленные - дальше. Наибольшую толщину слоя образовали атомы,
движущиеся с наивероятнейшей скоростью 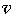 н,
которая составила около 500 м/с. Форма слоя в разрезе соответствует закону распределения
молекул по скоростям, найденному Дж. Максвеллом. Вид этого распределения изображен
на рис. 1.2. н,
которая составила около 500 м/с. Форма слоя в разрезе соответствует закону распределения
молекул по скоростям, найденному Дж. Максвеллом. Вид этого распределения изображен
на рис. 1.2.
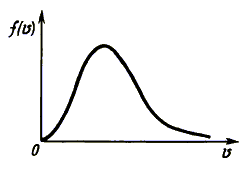
Рис. 1.2.
4. Силы
и энергия межмолекулярного взаимодействия. Между молекулами на малых расстояниях
одновременно действуют как силы притяжения, так и отталкивания. При приближении
двух молекул начинают преобладать силы отталкивания, при удалении - силы притяжения.
На рис. 1.3 изображен график
зависимости равнодействующей F сил взаимодействия двух молекул от расстояния
между ними. Для сил отталкивания выбрано положительное направление, для сил
притяжения - отрицательное.
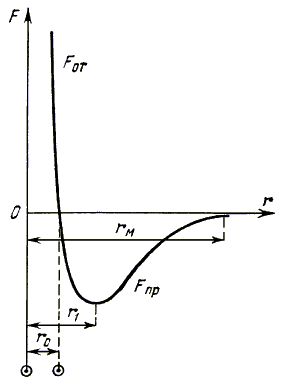
Рис. 1.3.
Расстояние
r0 на графике соответствует положению устойчивого равновесия
молекул, т.к. равнодействующая сил в этом случае равна нулю. На расстоянии r1
силы притяжения принимают максимальное по абсолютной величине значение. Если
удалось удалить молекулы на такое расстояние, то при дальнейшем увеличении расстояния
силы притяжения начинают убывать. Следовательно, расстояние r1
можно считать точкой разрыва.
Расстояние, на котором силы
взаимодействия молекул так малы, что ими можно пренебречь, называется радиусом
молекулярного действия rМ.
Силы взаимодействия имеют электромагнитную
природу и характеризуются потенциальной энергией. График ее зависимости от расстояния
между молекулами изображен на рис. 1.4. Заметим, что положению устойчивого равновесия
r0 молекул соответствует минимум потенциальной энергии.
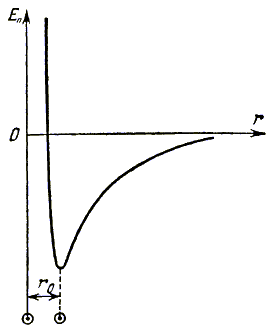
Рис. 1.4.
|