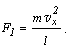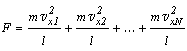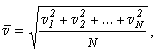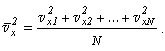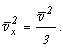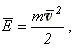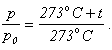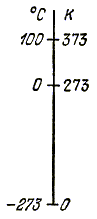|
§ 2. Кинетическая
теория газа.
Под
идеальным понимается такой газ, силами притяжения между молекулами которого
можно пренебречь, а объем, занимаемый молекулой, равен нулю.
Одним из параметров, определяющих
состояние газа, является давление:
[p] = Па.
Давление газа обусловлено
ударами молекул о стенки сосуда.
Прибор для измерения давления
называется манометром. Большие давления измеряются металлическим манометром,
а маленькие - закрытым жидкостным. Для измерения атмосферного давления служит
барометр.
Внесистемные
единицы давления.
Миллиметр
ртутного столба - давление, производимое столбом ртути высотой 1 мм на горизонтальную
поверхность.
Давление столба
жидкости вычисляется по формуле:
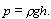
Подставляя в
нее плотность ртути 13600 кг/м3 и высоту столба 0,001 м, получаем:
1 мм рт. ст.
= 133,3 Па.
Атмосфера физическая
введена по среднегодовому атмосферному давлению на уровне моря, которое составляет
760 мм рт. ст.
Поскольку давление
равно отношению силы к площади поверхности, на которую она действует, атмосфера
техническая была введена следующим способом:
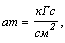
где кГс (килограмм-сила)
- сила равная весу тела массой один килограмм.
1. Основное
уравнение молекулярно-кинетической теории. Давление газа может быть выражено
через величины, характеризующие молекулы.
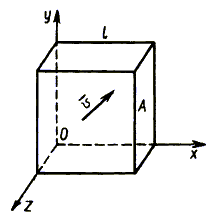
Рис. 2.1.
Пусть
в сосуде, имеющем форму куба с ребром l (рис. 2.1), находится газ. В
силу закона сохранения импульса при абсолютно упругом ударе молекулы стенка
A сосуда получает импульс:
 p
= 2m p
= 2m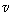 x. x.
Средняя сила
воздействия молекулы на стенку равна:
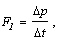
где 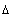 t
- время, приходящееся на один удар. t
- время, приходящееся на один удар.
Предположим,
что в сосуде находится всего одна молекула. Отразившись от стенки A,
она ударится о противоположную стенку и вернется обратно. Тогда 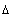 t
будет равно времени между двумя последовательными ударами: t
будет равно времени между двумя последовательными ударами:
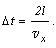
Следовательно:
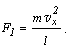
На самом деле
в сосуде находится огромное число молекул, но они, сталкиваясь, обмениваются
импульсами. Поскольку массы молекул одинаковы, получается такой же результат,
как если бы они прошли сквозь друг друга без столкновения, поэтому приведенные
выше рассуждения правомочны.
Если в сосуде
находится N молекул, имеющих одинаковые массы, но различные скорости,
то сила, с которой они все вместе воздействуют на стенку A сосуда, будет
равна:
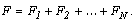
Подставляем вместо сил, действующих на стенку со стороны отдельных
молекул, выражение, полученное выше:
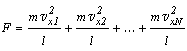
и выносим одинаковые множители за скобки:
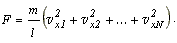
Величину
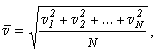
называют среднеквадратической скоростью молекул. По аналогии
можно записать:
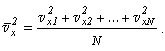
Отсюда получим:
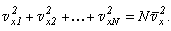
Таким образом, со стороны всех молекул газа на стенку действует
сила:
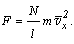
Если разложить
среднеквадратическую скорость молекул по осям координат на составляющие, то
по обобщенной теореме Пифагора получим:
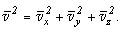
Поскольку все направления движения молекул равновероятны, имеем:
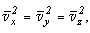
следовательно:
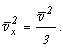
Учитывая это соотношение, получим:
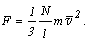
Разделив силу
на площадь l2 стенки A, находим давление на нее:
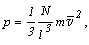
а учитывая, что l3 - объем сосуда, имеем:
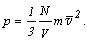
Концентрацией называется
количество молекул в единице объема.
[n] = м -3
В соответствии с определением
концентрация может быть вычислена по формуле:
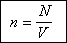
тогда получаем:
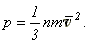
Полученное соотношение называется
основным уравнением молекулярно-кинетической теории газа. Обычно его
записывают иначе. Если учесть, что средняя кинетическая энергия молекул равна:
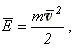
то:
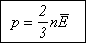
Значение данного уравнения
состоит в том, что в нем давление - макроскопический параметр, характеризующий
состояние газа как совокупности огромного числа молекул, выражается через микроскопический
параметр (относящийся к отдельным молекулам) - среднюю кинетическую энергию.
2. Зависимость
давления от температуры. С ростом температуры увеличивается скорость движения
молекул, они с большей силой ударяются о стенки сосуда, и, следовательно, газ
должен оказывать большее давление.
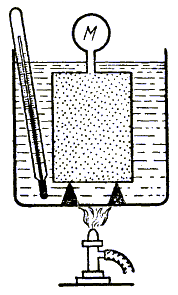
Рис. 2.2.
В
1787 году французский физик Ж. Шарль установил характер зависимости давления
от температуры. Схема опыта Шарля приведена на рис. 2.2, а график зависимости
на рис. 2.3.
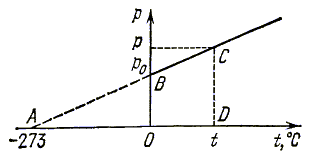
Рис. 2.3.
Поскольку
зависимость линейная, можно выразить ее в виде формулы. Для этого продолжим
график влево до пересечения с осью температур. Опыт, проведенный для различных
газов и при различных массах газа, показывает, что в пределах ошибок измерений
точка A получается в одном и том же месте.
Стороны подобных по двум углам
треугольников ABO и ACD пропорциональны, поэтому:
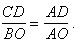
Устанавливая по оси давлений и температур длины данных отрезков, получаем:
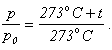
Выполним в правой части почленное деление и перенесем p0 из
левой части в правую:
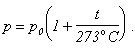
Величину
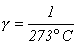
называют температурным коэффициентом давления. С учетом этого обозначения окончательно
получаем:
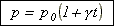
3. Термодинамическая
шкала температур. В точке A на графике (рис. 2.3) давление равно
нулю. Это означает, что молекулы не ударяются о стенки сосуда и, следовательно,
не движутся. Поскольку температура является мерой движения молекул (их средней
кинетической энергии), то значение –273°C является минимально возможным
для температуры.
Температура, при которой
должно прекратиться поступательное движение молекул, называется абсолютным нулем.
Точное значение
абсолютного нуля составляет –273,15°C, но для упрощения можно пользоваться
приближенным значением –273°C.
Целесообразный выбор шкалы температур
позволяет упростить формулы и глубже понять физический смысл наблюдаемых закономерностей.
В 1848 г. английский физик У. Кельвин предложил термодинамическую шкалу (шкалу
Кельвина), по которой температура откладывается от абсолютного нуля и называется
абсолютной температурой, а размер единицы температуры совпадает по величине
с градусом Цельсия и называется кельвином:
[T] = К.
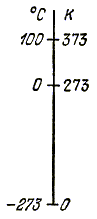
Рис. 2.4.
Соотношение
между температурой по шкале Цельсия и шкале Кельвина приведено на рис. 2.4,
а переход от одной шкалы к другой осуществляется по формулам:
T = 273 + t,
t = T – 273.
Средняя кинетическая энергия
молекул прямо пропорциональна термодинамической температуре. По предложению
немецкого физика Л. Больцмана соотношение между этими величинами для идеального
газа записывают в виде:
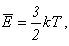
где k = 1,38·10 -23 Дж/К – постоянная Больцмана,
смысл которой будет выяснен ниже.
В общем случае приведенную выше
формулу следует записывать иначе.
Минимальное количество координат,
с помощью которых можно задать положение тела в пространстве, называется числом
степеней свободы.
Вращательное движение у молекулы
идеального газа, состоящей из одного атома, в силу бесконечной малости ее диаметра
отсутствует, поэтому она может совершать только поступательное движение и, следовательно,
имеет три степени свободы (координаты x, y и z).
Молекула, состоящая из двух
атомов, кроме поступательного движения совершает и вращательное относительно
двух взаимно перпендикулярных осей (рис. 2.5), поэтому имеет пять степеней свободы.

Рис. 2.5.
Наконец,
молекула, состоящая из трех и более атомов, может вращаться вокруг трех пространственных
осей (рис. 2.6) и поэтому имеет шесть степеней свободы.
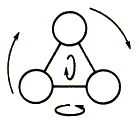
Рис. 2.6.
Таким
образом, имеем формулу Больцмана:
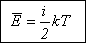
где i – число степеней свободы, принимающее значения:
i = 3 для
одноатомного газа,
i = 5 для
двухатомного газа,
i = 6 для
многоатомного газа.
|